FDA Dispositivos Médicos: Definiciones y Clasificaciones – Guía Completa
marzo 9, 2025

Sé de los primeros en recibir nuestros articulos de nuestro blog.
FDA Dispositivos Médicos. ¿Cómo lo define, qué taxonomía y restricciones tiene la FDA?
Todo dispositivo médico en Estados Unidos está regulado por la Administración de Alimentos y Medicamentos (FDA).
Comprender la definición de dispositivo médico para la FDA, así como la forma en que la agencia los clasifica, es una parte fundamental para aprender cómo introducir en este mercado un producto de estas características.
La FDA define un dispositivo médico como “un instrumento, aparato, implemento, máquina, artilugio, implante, reactivo in vitro u otro artículo similar o relacionado, incluyendo un componente o accesorio que esté (4 posibilidades):
Para determinar si su producto cumple con la definición de dispositivo médico de la FDA, primero se debe identificar el uso previsto (lo que hace el dispositivo médico) y las indicaciones de uso (la afección o enfermedad que el dispositivo médico diagnosticará, curará, mitigará, tratará o prevendrá) del dispositivo.
Luego, se puede ver si el dispositivo se encuentra dentro de la definición de la FDA.
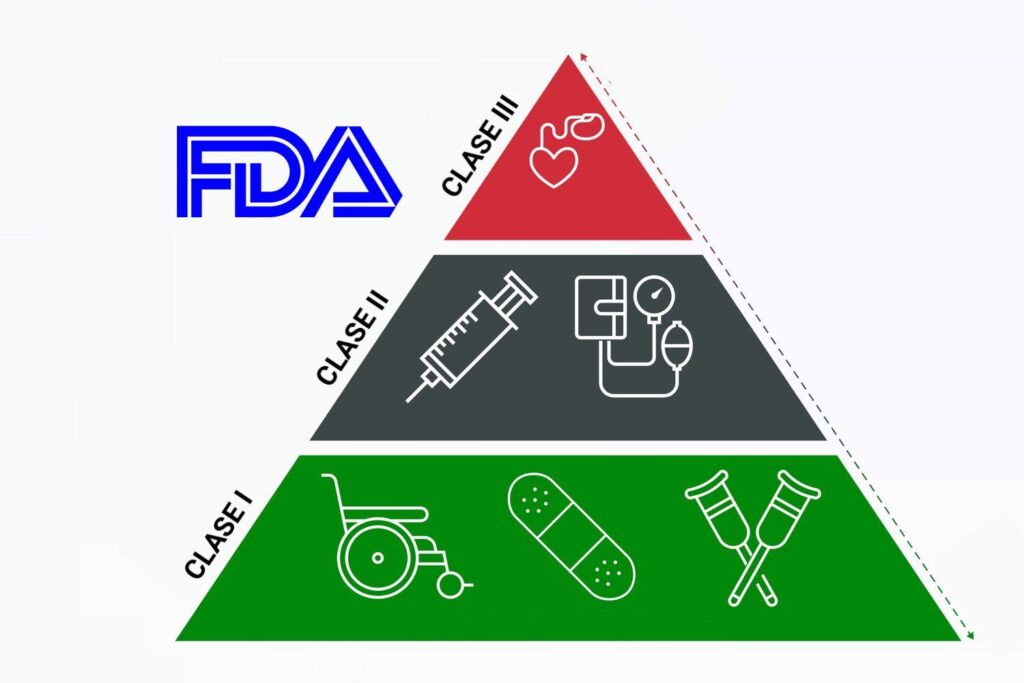
El Centro de Dispositivos y Salud Radiológica (CDRH) de la FDA clasifica todos los dispositivos médicos comercializados en los Estados Unidos en 3 amplias clasificaciones:
Cada clasificación viene con su propio conjunto de reglas que determinan cómo se pueden comercializar los dispositivos, desde qué requisitos deben seguir los fabricantes de productos hasta qué acciones deben completar antes de que el dispositivo pueda venderse en el mercado.
Las clasificaciones generalmente se asignan a los dispositivos médicos en función del riesgo potencial para el paciente y el nivel de control regulatorio de la FDA requerido para comercializar el dispositivo.
A medida que aumenta el nivel de clasificación, también aumenta el riesgo para el paciente y el control regulatorio.
1. Dispositivos de Clase I: los dispositivos médicos en la categoría de clase I tienen la menor cantidad de control regulatorio y un daño potencial mínimo para el paciente. Estos dispositivos son relativamente simples de diseñar, fabricar y usar.
2. Dispositivos de Clase II: Los dispositivos médicos de Clase II requieren una mayor regulación de la FDA para garantizar la seguridad y la eficacia.
3. Dispositivos de Clase III: Los productos utilizados para apoyar o sostener la vida humana o aquellos que presentan un riesgo potencialmente alto para un paciente se encuentran en la clasificación de Clase III. Estos dispositivos están, comprensiblemente, regulados de manera más rigurosa que los productos de Clase II o Clase I y requieren niveles adicionales de aprobación.
Además del nivel de riesgo, la diferencia más significativa entre las clasificaciones de dispositivos médicos de la FDA tiene que ver con el cómo se comercialización estos productos finalmente.
La clase para la que está diseñado un dispositivo determina lo que se requiere antes de que la FDA autorice el producto para su comercialización en EE.UU.
Los fabricantes interesados en vender un dispositivo médico en Europa, además de en EE.UU., deben estar familiarizados con las reglamentaciones de la Unión Europea (UE).
La rama de Directivas sobre dispositivos médicos de la Comisión Europea (CE) determina cómo se regulan los dispositivos médicos en la UE.
Aunque la CE tiene un sistema de clasificación similar (Clase I, Clase IIa, Clase IIb, Clase III), obtener la aprobación para su comercialización a nivel internacional puede ser un desafío.
Si una empresa está en proceso de crear un dispositivo médico, ¿cómo determina si es de Clase I, Clase II o Clase III?
La FDA clasifica los productos nuevos comparándolos con dispositivos médicos que ya han sido aprobados para su comercialización.
Al comparar el uso previsto de su dispositivo, las indicaciones de uso y las características tecnológicas con los productos aprobados, puede determinar la clasificación.
En la actualidad hay más de 1700 tipos de dispositivos médicos, agrupados en 16 paneles de especialidades médicas.
Estos paneles cubren en general las especializaciones médicas, como la cardiovascular, la inmunología o la fisioterapia.
El primer paso que debe hacer una empresa es elegir la especialidad médica que mejor describa su producto.
Luego, revisar la lista de categorías de dispositivos asociadas con esa especialidad hasta que encuentre una que sea comparable con su dispositivo.
Tras seleccionar la categoría regulatoria equivalente, la empresa tendrá detalles como el número de regulación, la clasificación, el uso previsto y las indicaciones de uso.
Luego, la pregunta clave: ¿La descripción del producto aprobado coincide con la suya? Si es así y cree que ha encontrado una buena coincidencia, es muy probable que haya descubierto la clasificación de su dispositivo.
Si no puede encontrar un producto equivalente en la base de datos de la FDA, no todo está perdido.
A veces, esto indica que su dispositivo es lo suficientemente novedoso como para requerir una «presentación excepcional» del dispositivo médico ante la FDA
En FastForward, nos especializamos en ayudar a empresas a navegar por el proceso de desarrollo de dispositivos médicos y en todas las regulaciones ante la FDA.
Podemos guiarlo a través de los protocolos de aprobación de la FDA, los requisitos de comercialización y los procesos de regulación de dispositivos médicos. Con nuestro enfoque holístico y liderazgo experimentado, en FastForward estamos listos para ayudarlo.
Comuníquese con nosotros hoy para obtener más información. Escribanos haciendo clic en este enlace o envíenos un WhatsApp, haciendo clic aquí o agendando una cita formal con un asesor en este link.
Escríbenos por Whatsapp

Si no renueva su registro antes de las 23:59 (EST) del 31 de diciembre, su número será eliminado de la base de datos de la FDA

¿Necesita ayuda?